
金属エッチング加工とは?各方式の違いと発生しやすい不具合、その対策を解説

金属材料に関する全60Pの技術資料を無料でダウンロードいただけます。
材料選定に必要な特性データをはじめ、重量・⻑さ換算表や硬さ換算表など金属にかかわる方にオススメのお役立ち資料です。
⇒ 技術資料ダウンロードはこちらから
金属結合とは、自由電子による金属元素と金属元素の結合のことをいいます。
金属は、原子核が電子を引き付ける強さである電気陰性度が弱いため、原子核から電子が離れ、陽イオンになりやすいという性質を持っています。
そして、原子核から離れた電子は、金属陽イオンの間を自由に動き回る”自由電子”として、複数の金属原子間に共有されます。
この自由電子と、陽イオンとの間のクーロン力(静電気力)によって金属原子同士は結合しているのです。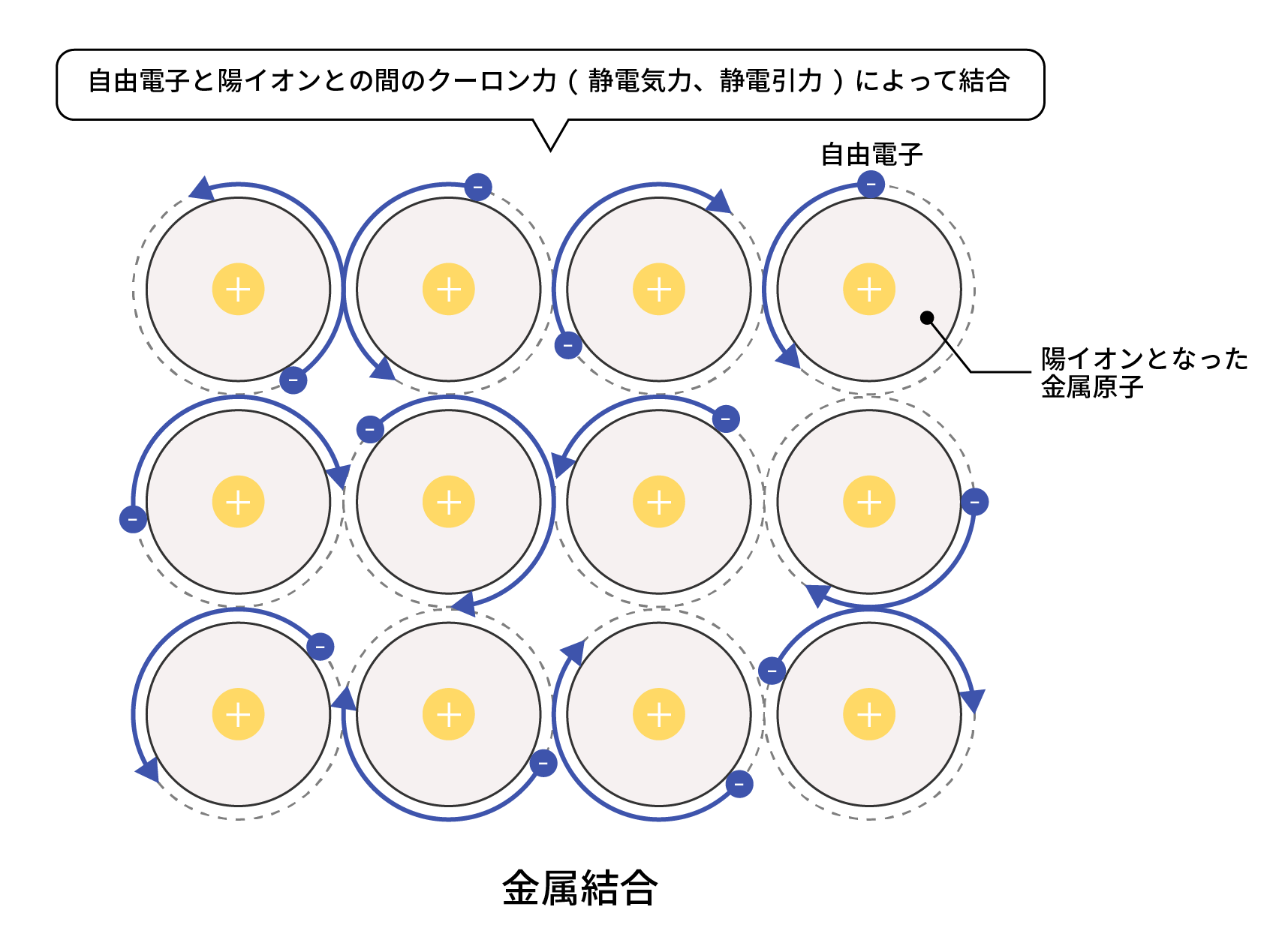
化学結合には、上述した金属結合のほかにイオン結合と共有結合があり、それぞれの違いは下表のようになっています。
| 金属結合 | イオン結合 | 共有結合 | |
|---|---|---|---|
| 組み合わせ | 金属原子と金属原子 | 金属原子と非金属原子 | 非金属原子と非金属原子 |
| 結合方法 | 自由電子と陽イオンのクーロン力(静電気力) | 陽イオンと陰イオンのクーロン力(静電気力) | 原子同士が出しあった価電子の共有 |
| 物質例 | Na,Al,Fe,Cu | NaCl,NaOH | ダイヤモンド,黒鉛,N2, CH4 |
| 特性 | 高い電気・熱伝導度 展性・延性 光沢 |
低い電気伝導度 透明 脆性 |
低い電気伝導度 非常に硬い 非常に高い融点 |
結合強さは、共有結合>イオン結合>金属結合の順になり、金属結合の結合力は共有結合、イオン結合に比べると低くなっています。
また、融点は結合の強さと関係しているため、融点温度は共有結合>イオン結合>金属結合と結合の強さと同じになります。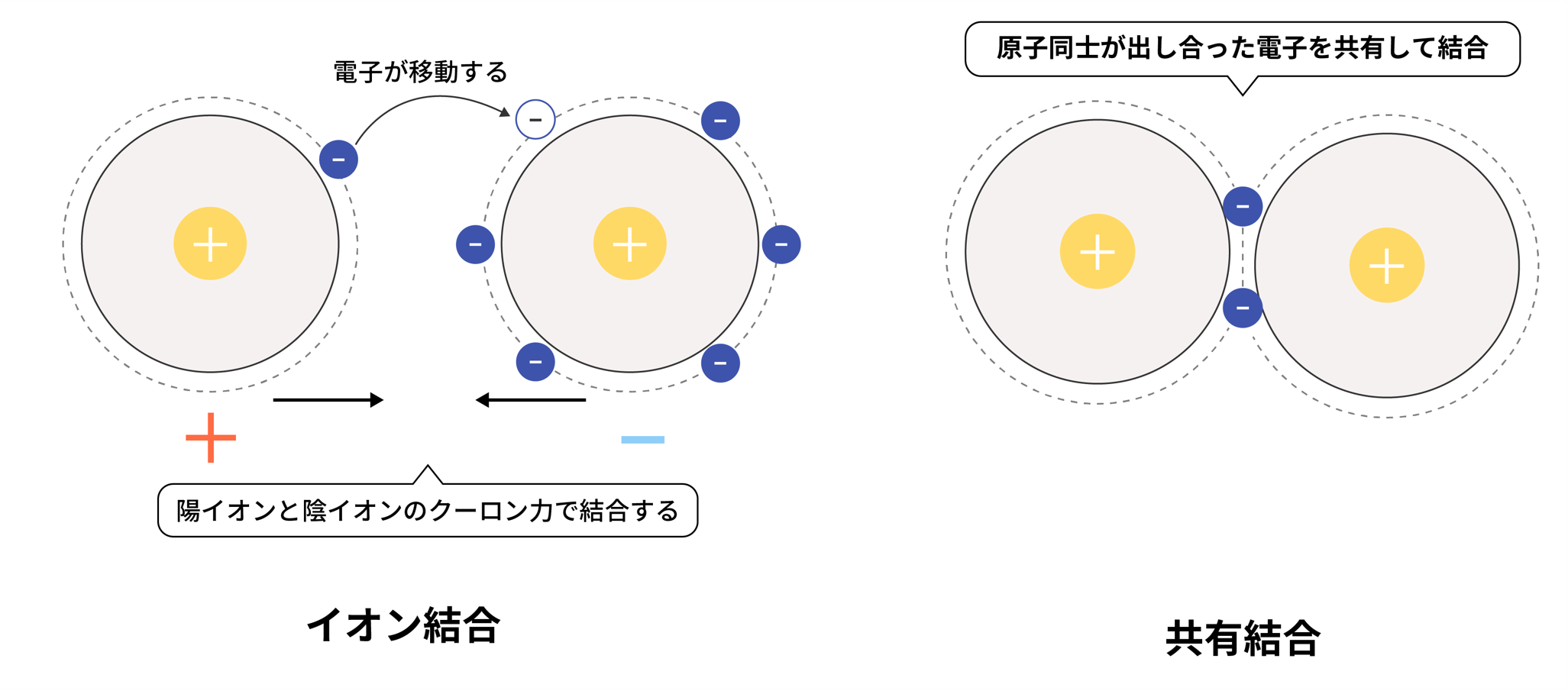
金属は、自由に動き回ることができる”自由電子”の存在によって、他の固体にはない以下のような特徴をもっています。
金属は、非常に高い電気伝導性を持っています。これは自由電子の存在によるものです。負の電気を帯びた自由電子が自由に動き回ることで電荷が運ばれ、電流が流れやすくなっています。
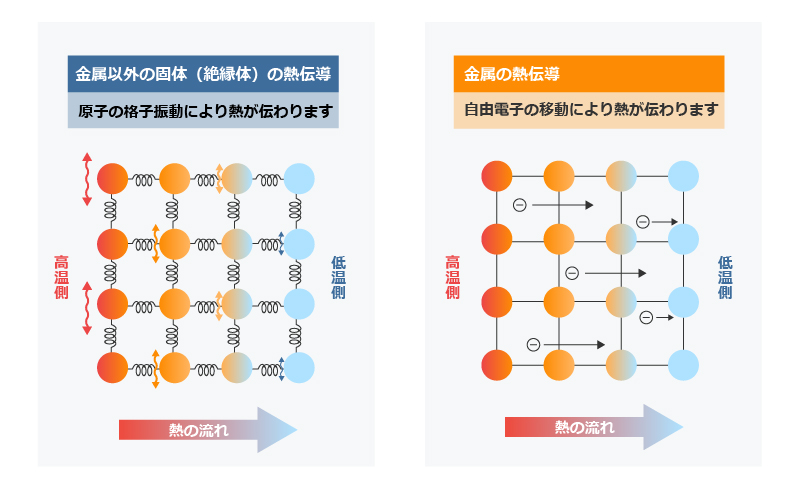
金属は電気伝導と同様に、非常に高い熱伝導性ももっています。
金属以外の固体は、原子が結晶構造をつくり、原子の振動が隣の振動に伝わっていくことにより熱が伝わる仕組みになっています。一方金属は、自由に動き回る自由電子が熱を運ぶため、広い範囲に素早く熱が伝わり、他の固体よりも熱伝導性が非常に高くなっているのです。
◆熱伝導については、以下の記事詳しく解説していますので併せてご確認ください。
⇒ 熱伝導の基礎知識│熱伝達との違いや金属における熱伝導について
金属は、たたくと薄く伸びる性質である展性と、引っ張ると伸びる延性という性質をもっていますが、これも自由電子の存在が関係しています。
金属以外の固体は、変形した際にイオン結合や共有結合が破壊されてしまいます。
一方、金属の場合は自由電子があるため、外部から加わった力による原子の移動にあわせて電子が動くことができます。よって、外力が加わっても金属結合が破壊されず、展性や延性といった性質をもつことができるのです。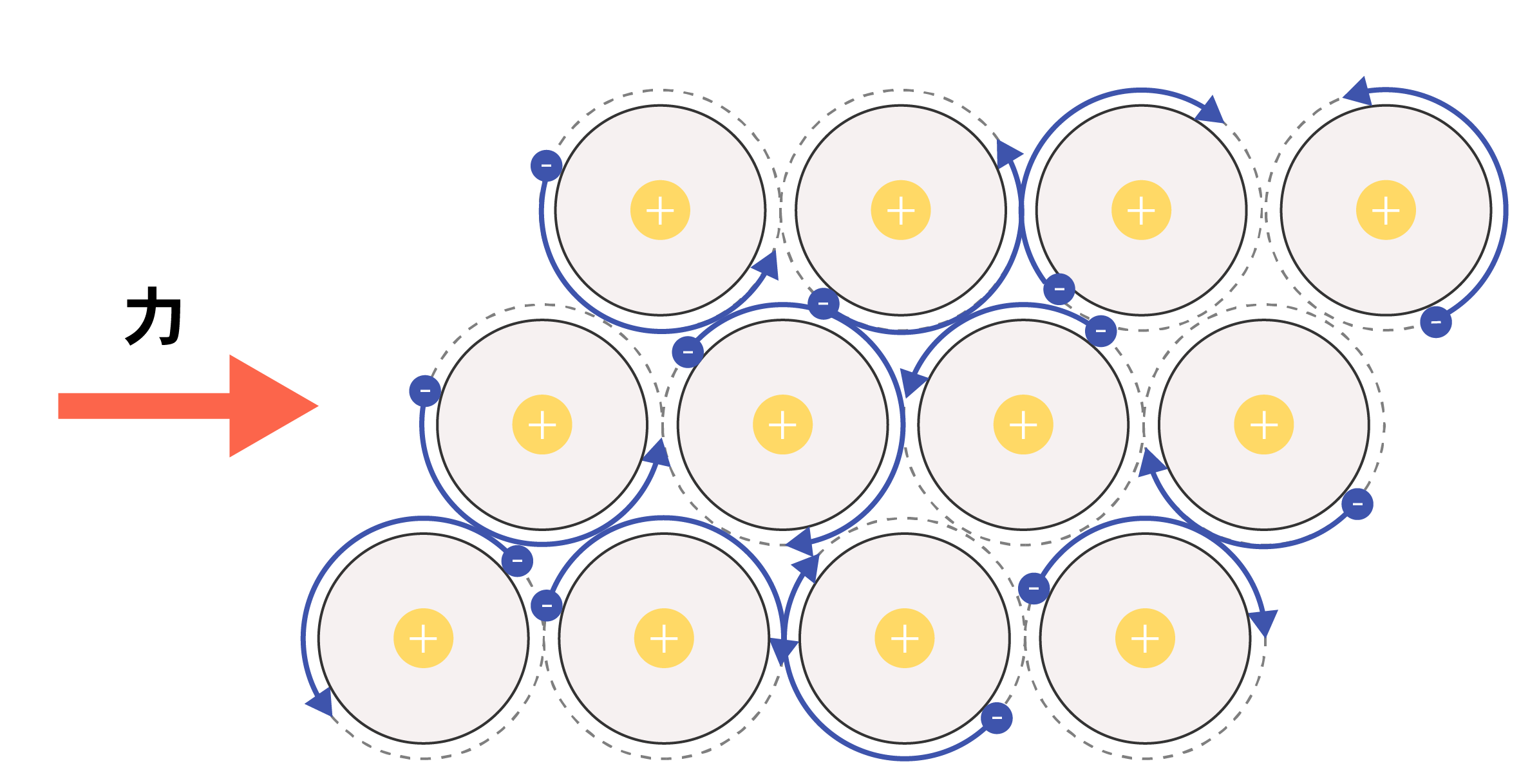
金属は、金属光沢といわれる金属固有の光沢をもっていますが、これも自由電子の存在によるものです。
自由電子は光を吸収すると、同じ周波数で振動し光を放出します。
よって、光沢があるように私たちの目には見えるのです。
また、銅は赤っぽい光沢があったり、金は黄金色の光沢があるように見えますがこれは、金属によって吸収、反射する光の波長が異なるためです。
例えば、銅は600nm付近より波長が短い黄色系の光を吸収し、それより波長が長い赤系の色を主に反射しているため赤っぽい色をしており、金は、500 nm 付近以下の緑、青、紫系の光を吸収し、それより波長が長い黄緑、黄色、赤系の色を主に反射しているため黄金色に見えます。
その他の金属は、可視光のほとんどを吸収するため、光沢の色に特徴はみられません。
金属結晶とその構造 金属結合によって形成される結晶のことを金属結晶といいます。
金属結晶は、規則的な繰り返し構造をもった結晶格子が集まってできていますが、金属の結晶格子には、面心立方格子、六方最密構造、体心立方格子、体心立方格子に炭素が入り込み1軸が伸びた状態の体心正方格子の4種類があり、以下のような特徴を持っています。
体心立方格子とは、下記の図のように立方体の各頂点と中心に原子が位置する構造です。
原子の数をみてみると、頂点にある原子は1/8分割されており、これが8個あるため1/8 x8で1個となり、さらに中心に1個あるため、合計2個あります。
体心立方格子構造をとる金属には、リチウム、ナトリウム、カリウムなどがあります。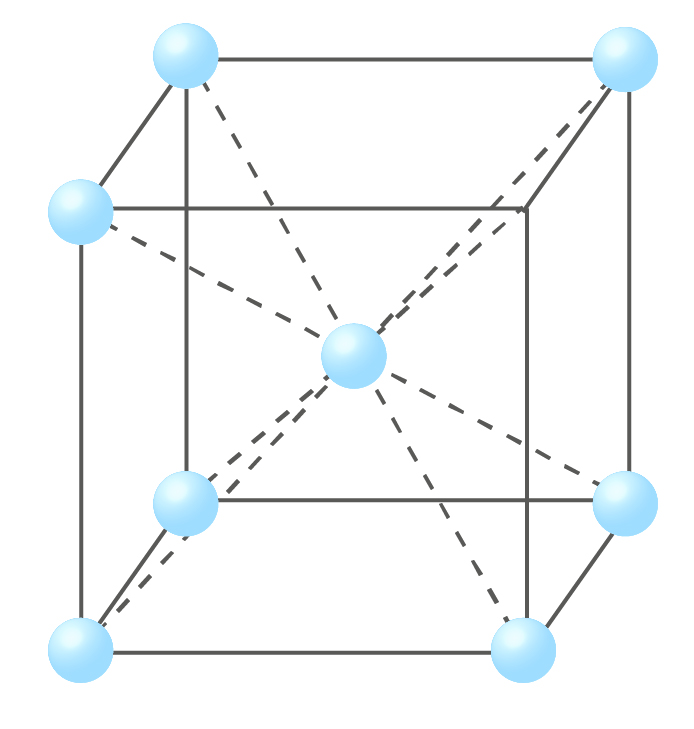
体心正方格子とは、体心立方格子の中に炭素が入り込み特定の軸が伸びた構造をしています。
炭素は下図のような位置に入り込み、この格子をもった組織は「マルテンサイト組織」と呼ばれます。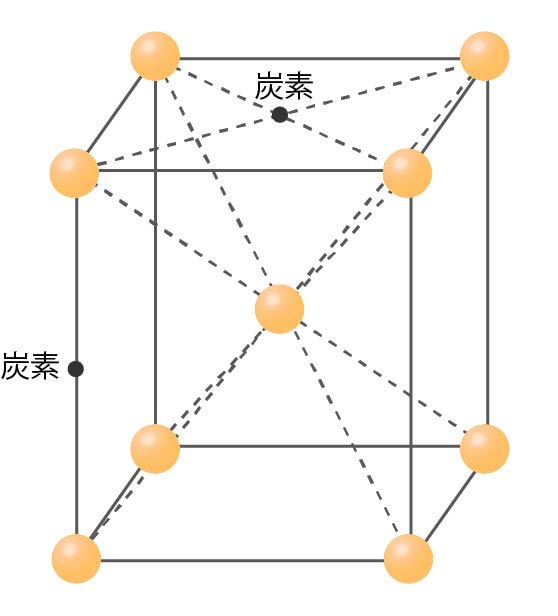
面心立方格子とは、下記の図のように立方体の各頂点と各面の中心に原子が位置する構造です。
原子の数をみてみると、体心立方格子と同じく頂点に1/8の格子が8個あるため1/8 x8=1個となり、各面にある原子は1/2でありそれが6面あるため、1/2X6=3個、よって3+1で4個となります。
面心立方格子構造を取る金属には、銅、銀、ニッケル、アルミなどがあります。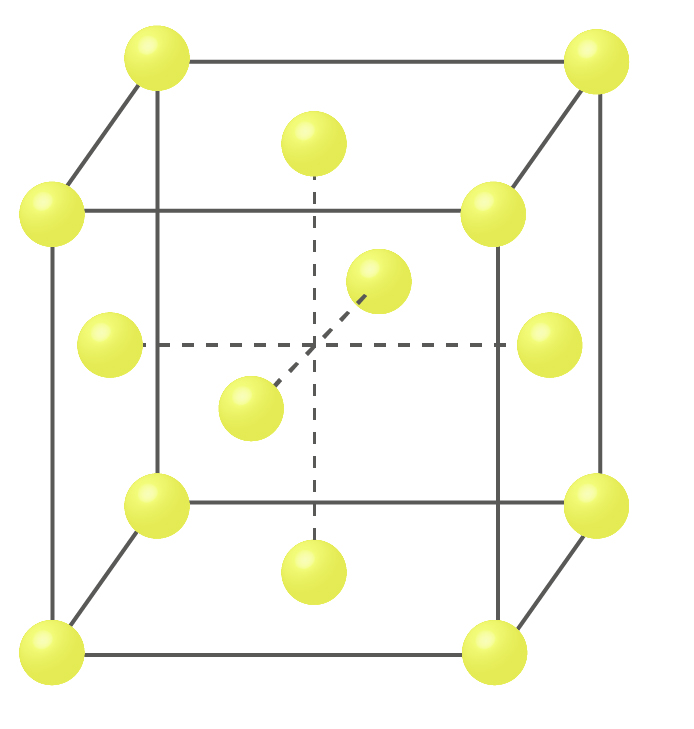
六方最密構造とは、下記の図のように六角柱を最小単位とするくり返し構造です。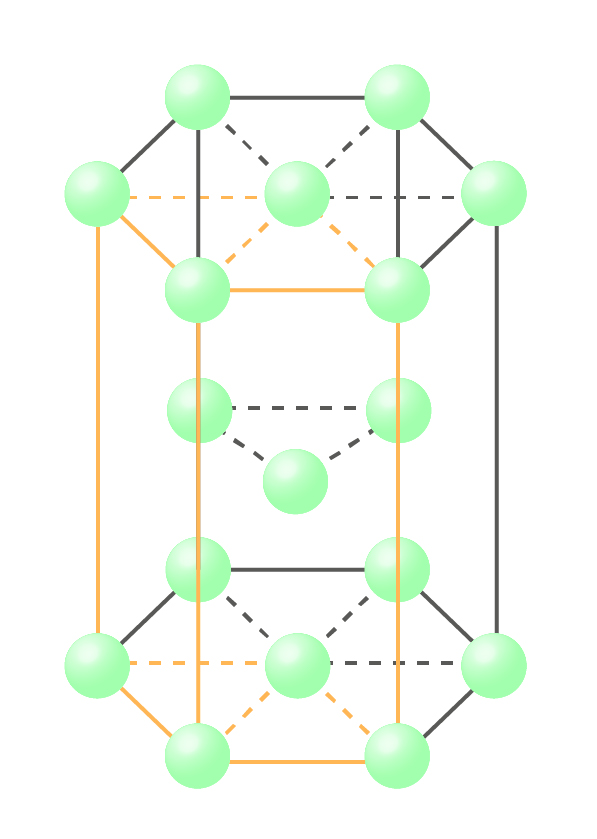
六方最密構造の単位格子は6角柱を1/3にしたものであるため、原子の数を見てみると、頂点の原子の数は1/12の原子と1/6の原子が4個ずつあり、1/12X2X2+1/6X2X2=1個となります。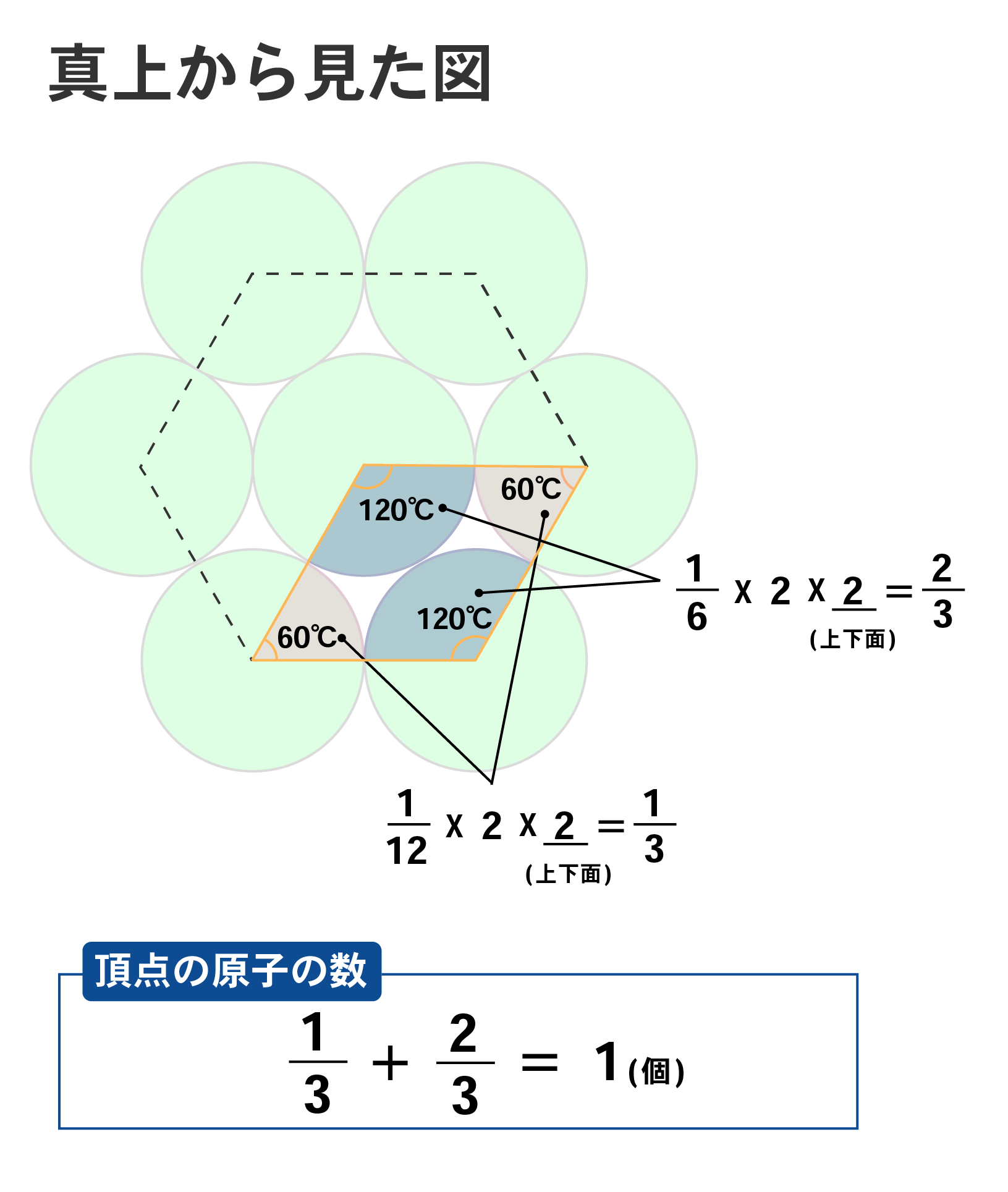
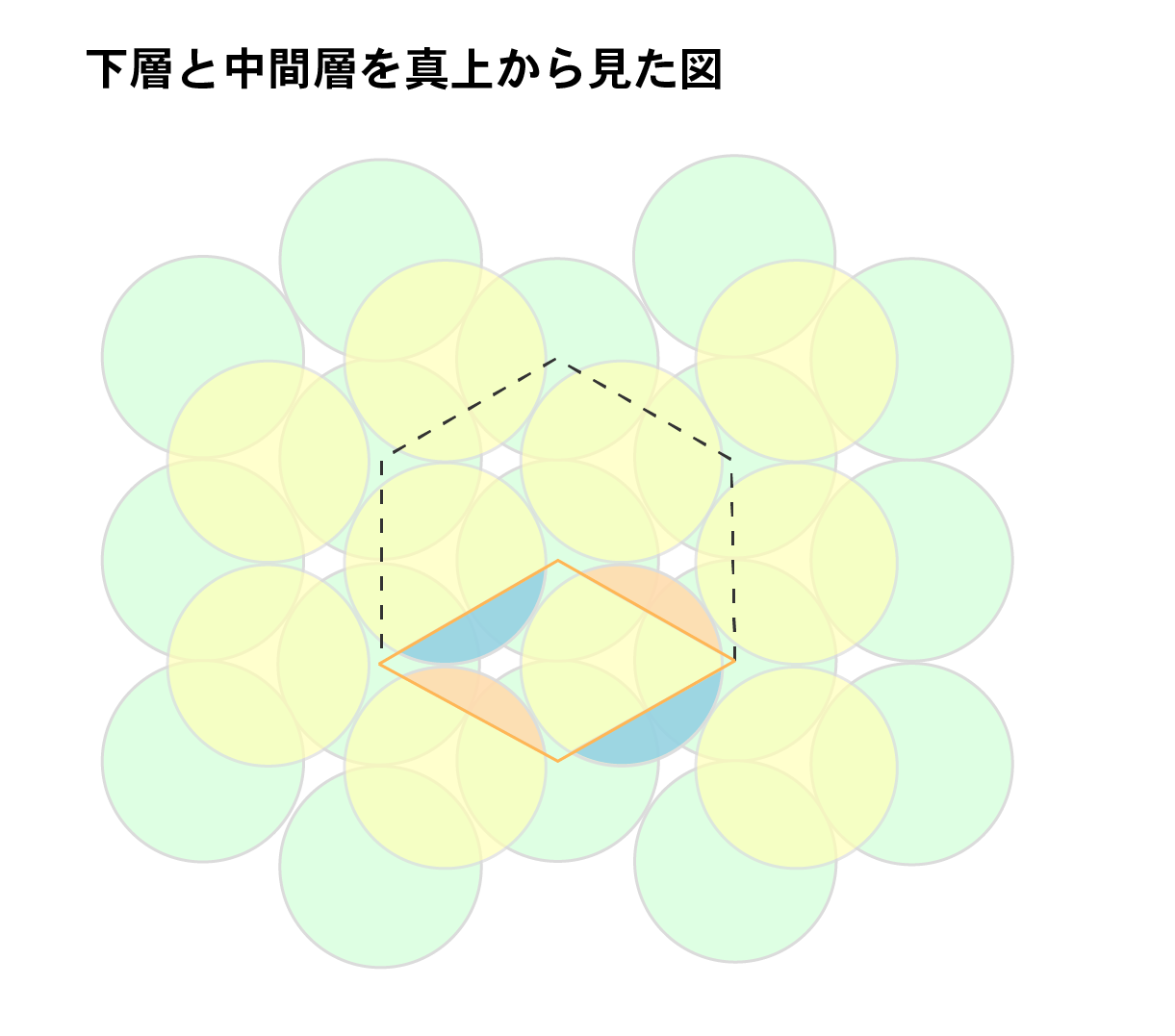
次に、中間層の原子の数を求めます。
上層をはぶいた結晶粒子を真上からみると以下のような構造になっており、同じ構造をもった粒子が無数につながりあっています。中間層の原子は、単位格子からはみ出る部分と隣り合う原子によって補われる部分の体積が等しいため、併せて1個になります。
よって、六方最密構造の原子の数は、1+1=2個ということが分かります。
六方最密構造をとる金属には、ベリリウム、マグネシウム、チタン、亜鉛などがあります。
ちょこっとメモ
ステンレス鋼は種類によって結晶構造が異なります。
| フェライト系ステンレス | 体心立方格子 |
|---|---|
| マルテンサイト系ステンレス | 体心正方格子 |
| オーステナイト系ステンレス | 面心立方格子 (但し、加工により加工誘起マルテンサイトが生成されるため体心正方格子に変化する) |
これらの結晶構造の違いが材料特性の違いに表れてきます。
極低温での靭性においては、面心立方格子は靭性が低下しにくいのに対し、体心立方格子や体心正方格子は脆くなります。
磁性においては、面心立方格子は磁石につかないのに対し、体心立方格子や体心正方格子は磁石につきます。
SUS304などのオーステナイト系ステンレスでよく問題になる加工後に磁性が出てしまう現象は、この結晶構造の変化によるものです。
◆ステンレス鋼の種類による違いを詳しく知りたい方は、以下の記事がおすすめです
⇒ 【ステンレス鋼の種類】成分系の違いによる主な特徴
以上金属結合について解説いたしました。
特殊金属エクセルでは、精密金属材料の開発・製造・販売を行っております。 金属材料に関して疑問点やお困りごとがございましたら、お問合わせフォームよりお気軽にお問い合わせください。
精密金属材料メーカーとして80年以上の実績を持つ特殊金属エクセルが運営。
長年培った知見や日々寄せられるお客様からのご相談を元に、技術開発と営業が連携してお客様の疑問や課題解決に役立つ情報を発信しています。
最新記事
タグ